专题笔谈 │糖原累积病的饮食与营养干预
陈永兴1,陆相朋2,杨艳玲3,卫海燕1
中国实用儿科杂志 2022 Vol.37(10):736-739
糖原累积病(glycogen storage disease,GSD)是由于先天性酶缺陷所造成的一组糖原代谢异常,患儿肝脏、肌肉、心肌组织内糖原累积,导致多种疾病,大多缺乏特效治疗,饮食和营养干预可改善部分糖原累积病患者的代谢紊乱,保证患者的生长发育,提高生存质量。应重视糖原累积病的长期营养管理。
基金项目:国家重点研发计划(2019YFC1005100)
作者单位:1.河南省儿童医院内分泌遗传代谢科,河南 郑州 450000;2.河南中医药大学第一附属医院儿科, 河南 郑州 450000;3.北京大学第一医院儿科,北京 100034
通讯作者:卫海燕,电子信箱:haiyanwei2009@163.com
糖原累积病(glycogen storage disease,GSD)是一组遗传代谢病由于基因缺陷导致糖原代谢途径中的酶缺乏或活性降低,使得肝脏、肌肉、心肌等组织内糖原累积,目前至少有12种类型,发病率为1/25 000~1/20 000[1]。根据受累的器官和临床表现分为肝糖原累积病(Ⅰ、Ⅲ、Ⅳ、Ⅵ、Ⅸ、Ⅺ、0型)和肌糖原累积病(Ⅱ、Ⅴ、Ⅶ型),不同类型临床表现有所差异,部分类型有特异的生化异常,基因检测是GSD诊断分型的金标准(表1)。目前除了GSD Ⅱ 型(庞贝病)可采用特异性酶替代治疗(ERT)外,其余类型均无特效药物治疗,饮食和营养干预是缓解临床症状、改善生活质量的有效方法[2-3],但是各种类型GSD的具体治疗方案不尽相同。现就GSD的饮食和营养干预进行阐述。
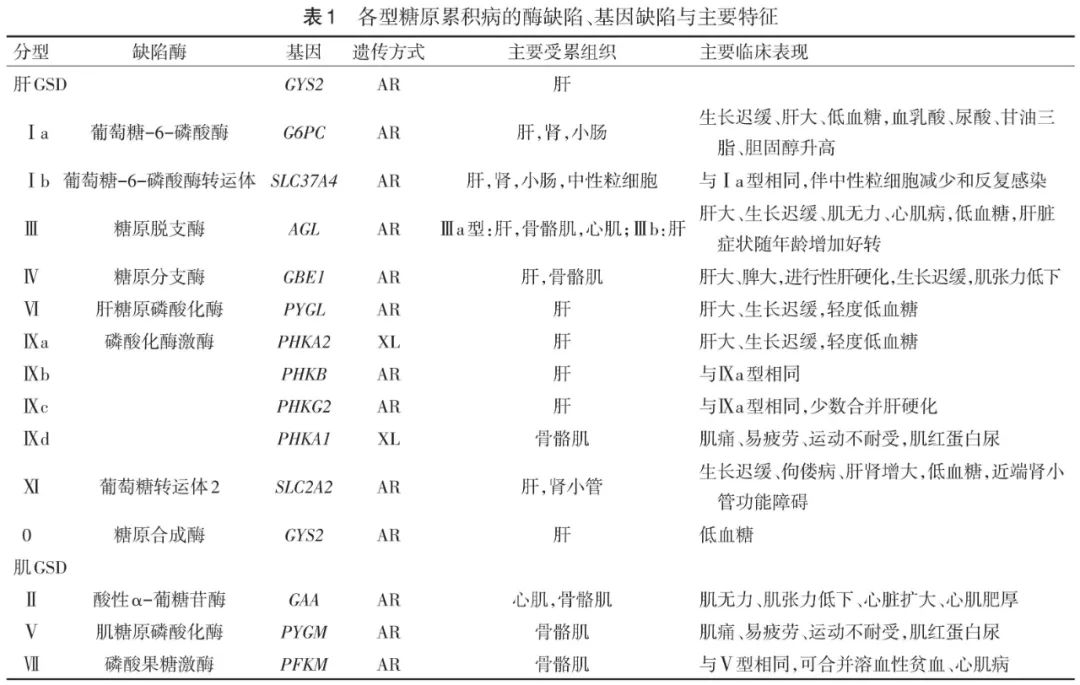
肝GSD临床主要表现为空腹低血糖和肝脏增大,其他器官也可能累及[4],如GSDⅠ型可能表现为肾功能障碍,GSDⅢ型、GSDⅣ型、GSDⅨ型可能表现为肌病,GSDⅪ型伴有近端肾小管功能障碍。肝GSD饮食和营养干预的总目标是维持餐前或空腹3~4 h血糖水平于3.9~5.6 mmol/L,预防继发代谢紊乱及并发症[3-4]。
1.1 生玉米淀粉 各型肝GSD以生玉米淀粉治疗为主[3-4]。因为生玉米淀粉能在肠道中缓慢释放葡萄糖,使血糖在较长时间内保持稳定。一般每次1.0~2.5 g/kg[5-10],以1:2比例与凉开水混合。每日4~6次,在两餐之间、睡前及夜间服用,需配合食物及血糖值来决定生玉米淀粉的次数和剂量。使用生玉米淀粉需注意,(1)6个月内婴儿不建议服用:因为此期缺乏胰淀粉酶,尚不能消化玉米淀粉,故推荐在6~12月龄后再开始玉米淀粉治疗,从小剂量开始,逐渐增加;(2)GSD 0型为糖原合成酶缺乏,一般只在夜间服用即可[10];(3)生玉米淀粉不可加热,也不可用热水冲泡;不能与柠檬汁或维生素C一起食用,否则生玉米淀粉中的葡萄糖会很快释放出来,造成血糖较大波动;(4)生玉米淀粉副反应主要为腹胀和(或)腹泻,可减量服用,必要时服用胰酶治疗。改良的玉米淀粉(Glycosade)较普通的玉米淀粉能更长时间(8~10 h)维持血糖稳定,在美国和欧洲已获批应用于2岁以上的儿童及成人患者过夜治疗,起始剂量为每次2 g/ kg,于睡前1次口服以维持夜间血糖稳定[11-12]。
1.2.1 婴儿期GSDⅠ型 患儿单糖和双糖利用障碍,建议换用不含蔗糖、乳糖和果糖的特殊医用配方或大豆(黄豆)奶粉。如果患儿出现持续高甘油三酯血症,可以选择富含中链甘油三酯的不含蔗糖、乳糖和果糖的特殊医用配方奶粉[5-6]。GSDⅪ型半乳糖利用障碍,需用免乳糖配方或大豆(黄豆)奶粉[9]。
建议少量多次喂养,防止低血糖,6月龄以下小婴儿一般2~3 h喂养1次,如果单次睡眠时间过长时,需及时唤醒小婴儿,监测血糖并提供喂养。随着月龄增加,可3~4 h喂养1次。如果家长不能坚持夜间每3~4 h喂养患儿,可以选择夜间鼻胃管或胃造口给予持续配方奶或葡萄糖喂养[3,13]。
1.2.2 幼儿、儿童及青少年期 不仅要防止儿童低血糖发生,还应注意营养均衡。GSD患者注意避免食用过多碳水化合物,以免加重肝脏中糖原的沉积及肥胖[3,5,13]。由于食用的食物品种受限,可能导致维生素及矿物质缺乏,需补充多种维生素及矿物质。
1.3.1 GSDⅠ型 糖原仅能分解到葡萄糖-6-磷酸,糖异生途径也受阻,因此患者膳食结构方面,碳水化合物需占总能量的60%~70%,乳糖、果糖、蔗糖等应该严格限制,每餐总量不超过2.5 g[5-6]。热量来源10%~15%为蛋白质,以优质蛋白为主,其余为脂肪,2岁以上患者的脂肪供能比不超过30%,脂肪最好以亚油酸等不饱和脂肪酸为主。给予低嘌呤饮食以减轻高尿酸血症。
1.3.2 GSDⅢ型 对于GSDⅢa型患者,饮食推荐高蛋白、低复合碳水化合物饮食[7],能量分布为45%的碳水化合物、25%的蛋白质和30%的脂肪。改良的阿特金斯饮食:高脂(65%)、高蛋白(25%)和低碳水化合物(10%)可以改善GSD Ⅲa型患者的心肌病[14],但必须长期密切监测潜在并发症,以便早期发现生长迟缓、肝损害和肝细胞癌[15]。GSDⅢb型患者可能只需要生玉米淀粉治疗,但高蛋白饮食可作为葡萄糖的替代来源,进而减少糖原在肝脏中的累积,对患者可能有益[7]。
1.3.3 GSDⅣ型 传统上,GSD Ⅳ型儿童的预后很差,许多患者在诊断时需考虑肝移植。但予以类似GSDⅢa型患者的高蛋白、低复合碳水化合物饮食后,不仅延缓或避免了肝移植,而且还改善了生长和空腹耐受性,血清氨基酸转移酶也恢复正常[16]。
1.3.4 GSDⅥ型和GSD Ⅸ型 推荐类似GSDⅢa型患者的高蛋白、低复合碳水化合物饮食。碳水化合物占总能量的40%~45%,减少单糖和二糖的摄入,避免血糖剧烈波动,减少糖原在肝脏的沉积,蛋白质占20%~25%,脂肪供能比30%[8]。
1.3.5 GSDⅪ型 又称Fanconi-Bickel综合征,近端肾小管功能障碍、葡萄糖和半乳糖利用障碍、肝肾糖原累积。所有患者需要补充足量的维生素D、钙和磷酸盐[20~50 mg/(kg·d),分成4次,以维持血浆磷酸盐浓度在1.2 mmol/L左右]、左旋肉碱[50 mg/(kg·d)]治疗;限制果糖和半乳糖,以避免乳酸生产过多;借鉴糖尿病的饮食原则,少量多餐,能量分布为碳水化合物占55%~60%、蛋白质占10%~15%、脂肪30%[9]。
1.3.6 GSD 0型 肝糖原合成障碍可引起餐后高血糖、高乳酸血症和高脂血症,在空腹状态下由于血糖生成减少,可引起脂肪酸β氧化增强,血酮明显增高[10]。本病患者应选择高蛋白及复合性低升糖指数碳水化合物饮食[3-4]。
1.4 血糖监测 对于监测病情、指导治疗至关重要,应根据患者的年龄、运动、进食和代谢控制情况个体化监测血糖。连续动态血糖监测系统是一种安全而较可靠的方法,可以监测24 h血糖动态,显著减少患者测量血糖频次,缓解患者及家属的低血糖焦虑,还可以检出无症状的低血糖,优化患者的长期治疗管理[17]。
2 肌GSD饮食与营养干预
肌GSD可分为两种:第1种特征为进行性肌无力、肌萎缩和(或)心肌病,以溶酶体糖原降解酶α-糖苷酶缺陷(GSDⅡ型)为代表;第2种表现为运动不耐受、运动相关的肌痛、肌痉挛、反复发作运动诱发的急性肌红蛋白尿和(或)横纹肌溶解,常见类型有GSDⅤ型、GSDⅦ型。通过饮食与营养干预可以改善肌GSD患者身体成分、肌肉功能,减轻运动不耐受症状[2,18-19]。
2.1 GSDⅡ型 近年来GSDⅡ型的诊断和药物治疗取得了重大进展,以重组人类酸性α-葡萄糖苷酶(rhGAA)治疗为核心的酶替代治疗显著提高了患者的存活率[20]。但消化系统并发症及营养问题是影响患者预后及生活质量的主要因素,仍需进一步解决。目前,针对患者的营养建议包括补充高蛋白(占总热量25%~30%)、低碳水化合物饮食。合并运动障碍的患者活动能力不足,能量消耗低,体脂偏高,而肌肉量偏低,出现少肌性肥胖。必须减少总能量摄入以避免肥胖,但仍需要保证优质蛋白质(牛奶、乳清、鸡蛋、瘦肉和鱼等)和微量元素、维生素(维生素D、维生素B12等)的摄入[18]。补充L-精氨酸、L-亮氨酸可能诱导细胞自噬、刺激蛋白质合成,有望成为潜在的辅助治疗方法[21]。补充一水肌酸、生酮饮食可能对患儿运动能力及肌肉功能改善有益处,但仍需要进一步评估研究[22]。
2.2 GSDⅤ型 国外多项研究发现适度的有氧运动训练和运动前饮食与营养干预有益于减轻运动不耐受症状。饮食指导包括剧烈运动之前口服蔗糖、富含碳水化合物的饮食、补充低剂量肌酸[60 mg/(kg·d)]等。富含碳水化合物的饮食可以维持肝糖原的储存,提供从肝脏到肌肉的更稳定的葡萄糖供应,因此优于富含蛋白质的饮食,但饮食管理并不会消除所有GSD V型的症状,因此肌肉损伤的风险仍然存在[19,23]。而最新的研究提示在GSD V型中,低碳水化合物生酮饮食(75%脂肪、15%蛋白质、10%碳水化合物)最有利于改善有氧运动能力和活动耐受性,可作为一种潜在的饮食管理策略[24]。
2.3 GSDⅦ型 关于GSDⅦ型的营养与饮食治疗国内外尚缺乏研究经验。运动前口服或静脉内补充蔗糖或葡萄糖不但没用,反而可能因降低脂肪酸、酮体等替代能量来源的浓度而造成不良后果[19]。长期的低碳水化合物生酮饮食可能会对GSDⅦ型患者受益,表现为运动耐量提高、呼吸功能改善、主观肌肉症状减轻[25],因此,特定患者可在密切的营养及医学监督下采用生酮饮食。
总之,各种GSD病情复杂,大多缺乏特效药物治疗,良好的饮食和营养干预可改善GSD患者的代谢紊乱,保证患者的生长发育,避免或减轻器官损害,提高生存质量。因此在GSD患儿的长期综合管理中,应重视个体化的饮食和营养干预。
